Vereloome tüvirakkude siirdamine
Milleks me vajame vereloome tüvirakke?
Vereloome tüvirakud asuvad luuüdis ning nendest arenevad kõik vere rakud- leukotsüüdid ehk valged verelibled, erütrotsüüdid ehk punased verelibled ning trombotsüüdid ehk vereliistakud. Vereloome tüvirakkude siirdamist kasutatakse paljude vereloome ja lümfisüsteemi haiguste nagu ägedad leukeemiad (äge müeloidne leukeemia, äge lümfoidne leukeemia) ja aplastiline aneemia, harvem lümfoomide, krooniliste leukeemiate (krooniline lümfoidne leukeemia ja krooniline müeloidne leukeemia), hulgimüeloomi ja müelodüsplaasiate raviks.
Vereloome tüvirakkude siirdamise puhul patsiendi enda haiguslik vereloome hävitatakse eelneva intensiivse keemia- või kiiritusraviga ning see taastatakse siirdamise käigus ülekantavate doonori vereloome tüvirakkude poolt.
Siirdatavad doonori vereloome tüvirakud peavad koesobivuse antigeenide poolest sobima patsiendi koesobivuse antigeenidega.
Koesobivuse antigeenid
Inimese koesobivuse antigeene ehk HLA (human leukocyte antigen) tüpiseerimist kasutatakse määramaks doonori sobivust konkreetsele retsipiendile (patsiendile). Koesobivuse antigeenid on valgulised markerid inimese rakkude pinnal ning immuunsüsteem kasutab neid võõraste rakkude äratundmiseks.
Vereloome tüvirakkude siirdamise puhul on väga oluline doonori ja retsipiendi vahelise koesobivuse antigeenide täpne kokkulangevus, mis vähendab riski, et retsipiendi immuunsüsteem ründab doonori rakke või koos vereloome tüvirakkudega ülekantavad doonori immuunsüsteemi rakud ründavad retsipiendi rakke.
Iga inimene pärib pool oma HLA markeritest emalt ja pool isalt nagu on näidatud järgneval joonisel. Seega ema või isa ja lapsed ei ole koesobivuse antigeenide poolest sarnased ega sobi üksteisele doonoriks. Ühe ema ja isa laste (õdede-vendade) koesobivuse antigeenide kokkulangevuse tõenäosus on 25%. Kaugemate sugulaste seast doonori leidmine on väga vähe tõenäoline.
Erinevaid koesobivuse antigeene tähistatakse sümbolitega A, B, C, DRB1, DQB1 ja DPB1 ning nende erinevaid variante nelja numbri kombinatsioonina. Igat tüüpi koesobivuse antigeeni on iga inimese rakkudel kaks- üks päritud emalt ja teine isalt.

Seega 75% patsientidest, kes vajaksid vereloome tüvirakkude siirdamiseks doonorit, ei leia seda oma õdede-vendade seast. Nende inimeste ainsaks võimaluseks on doonori leidmine vereloome tüvirakkude doonorite registrist.
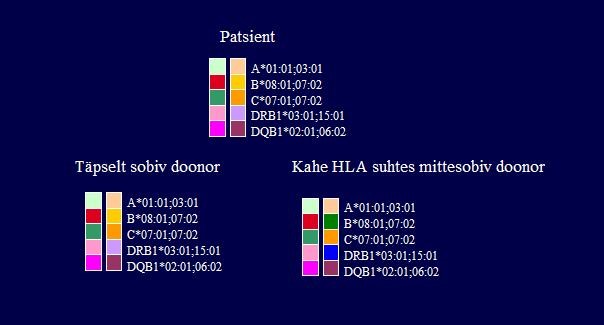
Ideaalselt sobival doonoril on täpne kokkulangevus retsipiendi HLA A, B, C, DRB1 ja DQB1 antigeenide paaridega.
Järgneval joonisel on näidatud täpselt sobiv doonor ja kahe koesobivuse antigeeni (B ja DRB1) osas mittesobiv doonor.
Vereloome tüvirakkude siirdamisest
Vereloome tüvirakkude siirdamist kasutatakse mitmete vereloome ja lümfisüsteemi haiguste nagu ägedad leukeemiad (äge müeloidne leukeemia, äge lümfoidne leukeemia) ja aplastiline aneemia, harvem lümfoomide, krooniliste leukeemiate (krooniline lümfoidne leukeemia ja krooniline müeloidne leukeemia), hulgimüeloomi ja müelodüsplaasiate raviks. Mitte kõikide nimetatud diagnoosidega patsientide raviprogrammi ei kuulu vereloome tüvirakkude siirdamine, selle ravimeetodi kasutamiseks on kindlad näidustused kus on arvestatud võimalike riskide ja saadava kasu vahekorda.
Vereloome tüvirakkude siirdamise puhul tuleb eristada autoloogset ja allogeenset siirdamist. Autoloogse siirdamise puhul kasutatakse patsiendi enda tüvirakke ning see meetod võimaldab siirdamiseelselt kasutada väga kõrgetes doosides keemiaravi hävitamaks tavadoosides teostatud keemiaravi järgselt ellujäänud kasvajarakke. Paraku hävitab kõrgetes doosides kasutatav keemiaravi ka patsiendi enda vereloome. See hävitatud vereloome taastatakse eelnevalt kogutud vereloome tüvirakkude ülekandega. Seda meetodit kasutatakse eelkõige selliste haiguste nagu lümfoomid ja hulgimüeloom raviks.
Allogeense siirdamise puhul aga kasutatakse doonorilt pärinevaid tüvirakke. Kõigepealt püütakse sobivat doonorit leida patsiendi õdede-vendade seast ning kui see ei õnnestu siis pöördutakse sobiva doonori otsinguks luuüdi doonorite registrite poole. Allogeense siirdamise puhul aitab võimalikke ellujäänud kasvajarakke lisaks siirdamiseelselt teostatavale keemia- ja/või kiiritusravile hävitada ka nn. transplantaat (siirik) leukeemia/lümfoomi vastane reaktsioon. Selle olemus seisneb selles, et koos doonori vereloome tüvirakkudega ülekantavad doonori T-lümfotsüüdid tunnistavad patsiendi organismis olevad kasvajarakud võõrasteks ning püüavad neid hävitada.
Vereloome tüvirakke on doonorilt võimalik koguda kolmel erineval viisil- luuüdist (siis me nimetame neid luuüdi tüvirakkudeks), mobiliseerides perifeersesse verre ning kogudest sealt rakuseparaatoriga (siis me nimetame neid perifeerse vere vereloome tüvirakkudeks) ning vahetult sünnijärgselt nabaväädi ja platsentaarverest (siis me nimetame neid nabaväädi vereloome tüvirakkudeks).
Doonori otsing
Kui patsiendi raviprogrammis osutub vajalikuks allogeenne vereloome tüvirakkude siirdamine, siis esmalt püütakse patsiendile sobivat doonorit leida tema õdede-vendade seast. Selleks määratakse nii patsiendil kui tema õdedel-vendadel koesobivuse antigeenid ning võrreldakse neid omavahel. Paraku kõigil meil õdesid-vendasid ei ole ja kui ka on, siis tõenäosus, et kellegi vend või õde sobib talle doonoriks on vaid 25%. Kui perekonnas doonorit ei ole, siis algatatakse doonori otsing luuüdi doonorite registritest.
Kõigepealt teostatakse nn. esialgne otsing, millega selgitatakse välja potentsiaalsete doonorikandidaatide olemasolu. Kui esialgne otsing osutub edukaks, siis võetakse patsiendilt teistkordselt vereanalüüsid koesobivuse antigeenide määramiseks. Nende vastuste saabumisel valitakse välja kolm-neli doonorikandidaati, kellel samuti määratakse teistkordselt koesobivuse antigeenid. Nüüd valitakse nende seast patsiendile kõige sobivam doonor, ideaalis peaks doonori ja patsiendi vahel olema 100% sobivus HLA A, HLA B, HLA C, HLA DR ja HLA DQ antigeenide osas. Mitme sobiva doonori olemasolul arvestatakse doonori valikul veel lisanduvaid faktoreid nagu doonori ja patsiendi sugu, veregruppide erinevust ja mõningaid teisi faktoreid.
Sobiva doonori olemasolul teostatakse lõplik valik, hinnatakse veelkord patsiendi valmisolekut siirdamiseks ning siis toimub lõplik kuupäevade kokkuleppimine siirdamiskeskuse, doonorkeskuse ja doonori vahel.
Vereloome tüvirakkude siirdamise protsess
Patsient võetakse haiglasse sõltuvalt siirdamiseelse ravi pikkusest 7- 14 päeva enne planeeritavat siirdamise kuupäeva. Esmalt asetatakse patsiendile tsentraalne veenikateeter, kuhu manustatakse kõik siirdamiseelselt ja siirdamisjärgselt kasutatavad ravimid.
Vahetult siirdamiseelselt saab patsient ettevalmistava ravikuuri, mis koosneb kõrges doosis keemiaravist või keemia- ja kiiritusravi kombinatsioonist. Seda ravikuuri nimetatakse konditsioneerivaks ravikuuriks ning sellel on kolm eesmärki- võimalike tavakeemiaravi järgselt allesjäänud kasvajarakkude hävitamine, patsiendi enda vereloome hävitamine loomaks ruumi doonorilt pärit rakkudele ning immuunsupressioon vältimaks siirdamisest tulenevaid võimalikke sobimatusest tulenevaid tüsistusi.
Doonorilt pärinevad rakud kantakse patsiendile üle veenisiseselt ja tehniliselt meenutab see verekomponentide ülekannet.
Juba siirdamiseelselt hakatakse patsiendile manustama immuunsust allasuruvaid ravimeid, et vältida võimalikke sobimatusest tulenevaid probleeme. Immuunsupressiivne ravi kestab siirdamisjärgselt 6-12 kuud.
Vereloome tüvirakkude siirdamine ei ole ühemomentne tegevus, vaid pigem kuid kestev protsess. Lõplik vereloome asendumine doonori vereloomega võib aega võtta kuid. Näiteks doonori ja patsiendi veregruppide erinevuse puhul asendub patsiendi enda vana veregrupp doonori veregrupiga lõplikult alles kuude möödudes. Vahepeal on periood, kus patsiendil on kaks erinevat veregruppi ehk teda nimetatakse kimääriks (kimäär on vanakreeka mütoloogias olend, kes Hesiodose järgi on eespoolt lõvi, tagantpoolt madu ja keskelt kits).
Varane siirdamisjärgne taastumine
Siirdamisjärgselt algab vereloome taastumine 10-14 päeva peale doonori rakkude ülekandmist. Vahepeal on periood, kus patsiendi enda vereloome on juba siirdamiseelse konditsioneeriva raviga hävitatud ning ülekantud doonori rakud ei ole veel jõudnud vereloomet taastada. Sellel perioodil patsiendi vere analüüsis valgete vereliblede arv langeb nullini, oluliselt langeb ka trombotsüütide ehk vereliistakute ning erütrotsüütide arv. Erütrotsüütide ja trombotsüütide arvu langust on võimalik kompenseerida verekomponentide ülekannetega. Leukotsüütide arvu langus teeb patsiendi vastuvõtlikuks erinevate bakteriaalsete infektsioonide suhtes. Bakteriaalsed infektsioonid ongi varases siirdamisjärgses perioodis patsienti kõige enam ohustavaks faktoriks.
Teiseks väga oluliseks siirdamisjärgseks tüsistuseks on transplantaat (siirik) peremehevastane haigus (reaktsioon). See reaktsioon tuleneb doonori ja patsiendi rakkude vahelisest immunoloogilisest sobimatusest. Kuigi siirdamiseelselt püütakse patsiendile parim sobiv doonor, ei suuda siirdamiseelsed sobivusproovid siiski kõiki probleeme ära hoida. Transplantaat peremehevastase reaktsiooni puhul tunnistavad koos vereloome tüvirakkudega ülekantavad doonori T-lümfotsüüdid patsiendi organism võõraks ning püüavad seda kahjustada. Samas on need ülekantavad doonori T-lümfotsüüdid vajalikud võimalike keemiaravi üleelanud kasvajarakkude hävitamiseks. Esimese 100 siirdamisjärgse päeva jooksul tekkinud transplantaat peremehevastast haigust nimetatakse ägedaks ning väljendub see põhiliselt kolme vormina- nahalööbena, kõhulahtisusena või maksafunktsiooni langusena.
Hiline siirdamisjärgne taastumine
Sarnane transplantaat peremehevastane reaktsioon võib vallandud ka hilisemas perioodid, siis nimetatakse teda krooniliseks. Seda iseloomustab emanati ketendav nahalööve, suu limaskesta kuivus või valulikkus, silmade kuivus, maksafunktsiooni langus, kõhulahtisus, tupe limaskesta kuivus.
Hilisemas siirdamisjärgses perioodis, kui valgete vereliblede arv on juba taastunud ning bakteriaalsete infektsioonide oht vähenenud kuid spetsiifilisemad immuunmehhanismid ei ole veel taastunud saavad patsienti ohustama viirus- või seeninfektsioonid. Lõplik immuunsuse taastumine võtab aega kuni kaks aastat.
Varases haiglajärgsel perioodil kuni immuunsupresseeriva ravi lõpuni käivad patsiendid esialgu igal nädalal, hiljem üle nädala kontrollil, kus neilt võetakse vere analüüsid ning hinnatakse nende seisundit.
Komplikatsioonide olemasolul võib osutuda vajalikuks statsionaarne haiglaravi.
Siirdamisjärgsed kuud ja aastad
Taastumise vereloome tüvirakkude siirdamisest toimub järk-järgult ning selle kiirus on väga individuaalne. Esimesel siirdamisjärgsel aastal esinevad siiski teatud piirangud, millega patsient peab arvestama. Komplikatsioonide puudumisel saab patsient naasta oma endise elukorralduse juurde enamasti teisel siirdamisjärgsel aastal.
Ühe- kahe aasta möödumisel alustatakse ka vaktsineerimisprogrammiga, sest siirdamise käigus on hävinenud immuunsus nende haiguste vastu, mille vastu patsienti lapsepõlves vaktsineeriti.
Vereloome tüvirakkude siirdamise eesmärgiks on alati patsiendi täielik tervistumine ning naasmine oma endise elukorralduse juurde.
Koostaja: dr Ain Kaare
2023